汪贻广团队发展程序调控肿瘤及淋巴结免疫微环境的纳米递释新策略
近日,学术期刊《Nano Letters 》在线发表了北京大学药学院天然药物及仿生药物国家重点实验室汪贻广研究团队的最新研究成果“Cooperative Self-Assembled Nanoparticle Induces Sequential Immunogenic Cell Death and Toll-Like Receptor Activation for Synergistic Chemo-immunotherapy”(双模块自组装纳米粒程序诱导免疫原性死亡和Toll样受体激动实现协同化疗免疫治疗)的研究工作。

相较于传统的肿瘤治疗方式如手术、化疗和放疗等,肿瘤免疫疗法已经成为一种更为强大的治疗手段,其利用宿主免疫系统来识别和杀伤原位和转移性肿瘤病灶,并建立长期的免疫记忆,抑制肿瘤复发。现阶段在临床中使用较广的是免疫检查点阻断疗法和嵌合抗原受体T细胞疗法,但是这些免疫疗法只对一小部分肿瘤患者有效。这一现象源自肿瘤多为“冷”肿瘤,表现为肿瘤组织自身免疫原性低,且具有高度抑制性的肿瘤免疫微环境,细胞毒性T淋巴细胞活化和浸润差等。因此,如何通过纳米策略,精准递送药物,程序调控肿瘤组织及引流淋巴结的免疫微环境,实现对多种肿瘤类型普适及有效的治疗效果,是亟待解决的科学问题。
有鉴于此,汪贻广研究团队基于课题组发展的pH超敏感纳米递释技术平台,构建了肿瘤微环境和淋巴结树突细胞酸性内吞体程序响应的聚合物–药物偶联物协同自组装纳米粒(SRNs),它由特异性靶向肿瘤微环境的“免疫原性死亡诱导模块”和靶向肿瘤前哨淋巴结的“免疫激动模块”构成。“免疫原性死亡诱导模块”可以在肿瘤微环境中快速解散,向肿瘤深部渗透,并响应性释放阿霉素,全方位诱导免疫原性细胞死亡效应,产生广泛的肿瘤抗原,并逆转肿瘤组织的免疫抑制微环境;“免疫激动模块”有效引流进入前哨淋巴结,响应于树突细胞内吞体的微酸性环境并发生解散,激动剂IMDQ与Toll样受体7/8结合,实现特异性免疫激动效应,减少了全身的毒副作用,从而实现了时间与空间的程序释药,协同杀伤肿瘤。
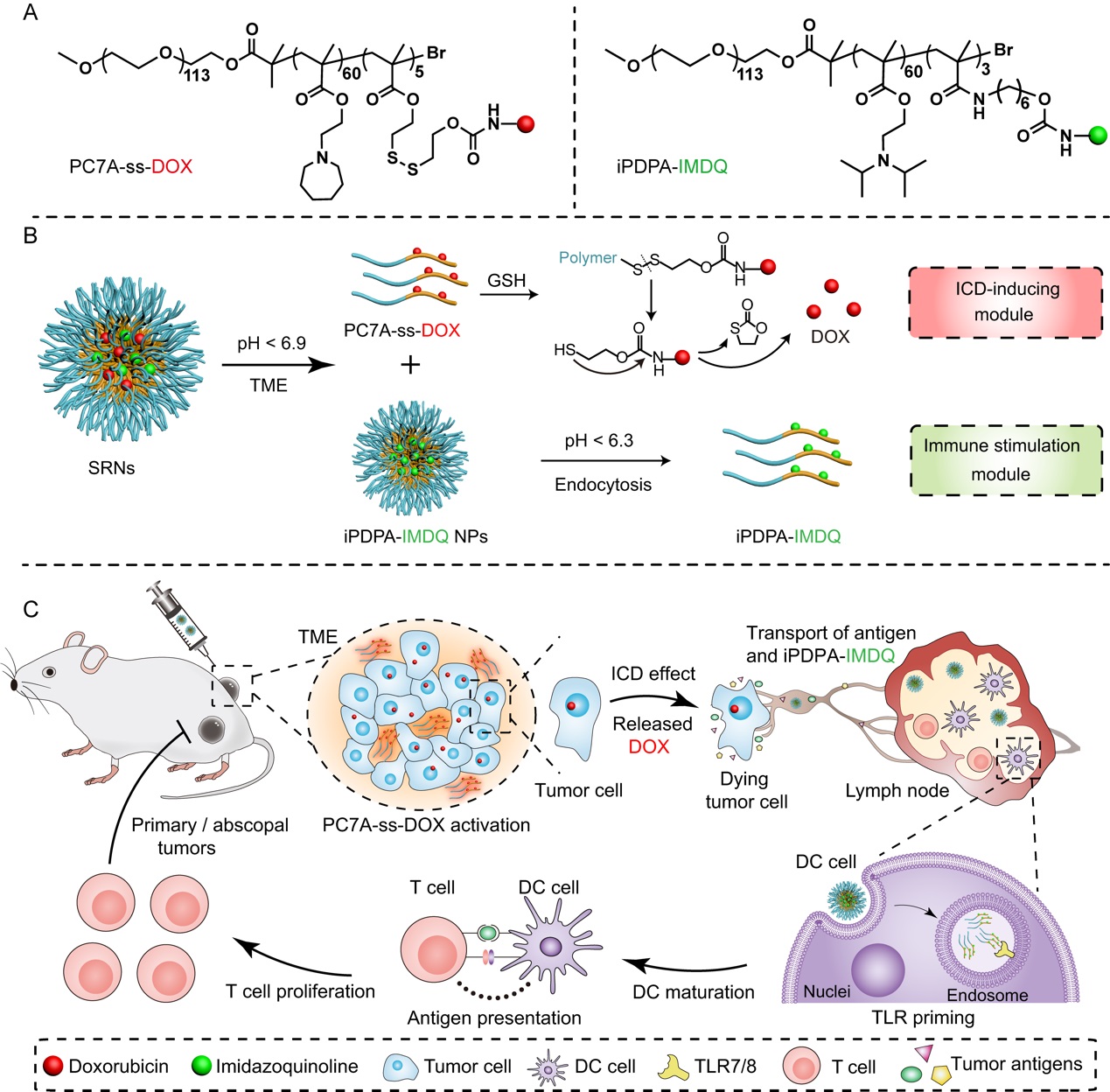
体内结果表明:SRNs可以诱导抗原特异性T细胞激活,增加肿瘤组织中细胞毒性T淋巴细胞的浸润,改善肿瘤免疫微环境。且由于无需依赖于特定的抗原,在B16-OVA和CT26两种肿瘤类型上均表现出较好的抑制效果,并能有效抑制远端肿瘤和转移肿瘤的生长,全身毒副作用较小。这种协同自组装的纳米设计为纳米药物的发展提供了新策略。
汪贻广研究员为本研究论文的通讯作者,北京大学药学院2018级博士研究生王瑶琪和王增辉为论文的共同第一作者。该工作得到科技部重点研发计划、国家自然科学基金、北京市自然基金杰出青年基金等项目资助。
原文链接:https://pubs.acs.org/doi/10.1021/acs.nanolett.1c00977
【延伸阅读】作者简介:

汪贻广,博士,北京大学研究员,博士生导师,药学院药剂学系主任,天然药物及仿生药物国家重点实验室PI,入选中组部高层次人才。主要从事智能纳米药物递送及疾病诊疗研究,取得了一系列创新性成果,以第一作者或通讯作者在Nat. Mater. 、Nat. Commun. 、Angew. Chem. Int. Ed. 、Adv. Mater. 、Adv. Funct. Mater. 、Adv. Sci. 、Nano Lett. 等国际著名期刊上发表SCI学术论文50余篇。作为负责人获得国家自然科学基金“优秀青年科学基金”、北京市自然基金“杰出青年科学基金”、国家重点研发计划等资助。先后获得2015年中国药学会-中恒青年药剂学奖、2017年中国药学会-赛诺菲青年生物药物奖。目前担任中国药学会药剂学专委会委员、中国药学会纳米药物专委会委员等。
(北京大学药学院天然药物 仿生药物国家重点实验室)
编辑:玉洁


