科技创新助推高质量发展 北京大学第三医院多项科技成果发表
北京大学第三医院围绕科技创新工作,通过平台搭建、资源配置、经费支持等多方面,为全院开展创新工作搭建了广阔的舞台,创造了科技发展新生态。各研究团队积极探索,创新能力明显提升,各研究团队取得了多项科研成果。下面向大家介绍3篇在国际高水平期刊上发表的成果。
毛凤彪研究员/乔杰院士团队建立首个实现eccDNA数据整合和表观遗传调控预测的分析平台
2022年1月7日,北京大学第三医院毛凤彪研究员/乔杰院士团队和中科院北京基因组研究所李明锟团队合作在Biochemistry & Molecular biology(生物化学与分子生物学)领域排名第八的Nucleic Acids Research数据库专刊上发表了“CircleBase: an integrated resource and analysis platform for human eccDNAs”的论著,建立了预测染色体外环状DNA(eccDNA)在表观遗传层面调控基因表达功能的数据库平台CircleBase,通过结合测序数据集、计算预测和手工注释等,对目前公开发表的60多万个eccDNA表观遗传调控潜能完成了系统的梳理和预测。
随着高通量测序技术的快速发展,人类基因组中发现了成千上万个染色体外环状 DNA(eccDNA)。因为eccDNA和线性染色体具有序列同源性,功能缺失实验很难在环形和线性染色体上独立进行。因此解释eccDNA的分子功能极具挑战性。
为了解决这个问题,研究团队建立了一个集成的数据资源和分析平台CircleBase (http://circlebase.maolab.org),用于管理和注释多种细胞类型中的eccDNA。CircleBase通过结合测序数据集、计算预测和手动注释来识别可能的功能性eccDNA。
数据库平台包括靶向基因、表观遗传调控、调控元件、染色质可及性、染色质相互作用和遗传变异六大部分。CircleBase提供了一个用户友好的界面,用于搜索、浏览和分析各种细胞/组织类型中的eccDNA,为筛选潜在的功能性eccDNA并解释它们在人类癌症和其他疾病中的分子机制提供了有力工具。

CircleBase数据库流程图
此工作由北京大学第三医院、中国科学院北京基因组研究所、武汉大学人民医院等机构联合完成。北京大学第三医院毛凤彪研究员、乔杰院士和中科院基因组所李明锟为该论文的通讯作者,北京大学第三医院赵晓璐副研究员、中科院基因组所史雷胜博士和武汉大学人民医院阮莎莎博士为该论文的共同第一作者。该研究获得国家自然科学基金、北京大学临床医学+X青年专项基金和北京大学第三医院临床重点项目基金资助。
原文链接:https://academic.oup.com/nar/article/50/D1/D72/6430829?login="false#325778405
刘忠军教授团队证明光功能化技术对3D打印多孔钛合金假体的促成骨改性作用
2022年1月,北京大学第三医院刘忠军教授团队在Materials science, Biomaterials(生物材料科学)领域排名第一的Bioactive Materials杂志正式出版了题为“Surface treatment of 3D printed porous Ti6Al4V implants by ultraviolet photofunctionalization for improved osseointegration”的论著,证明了光功能化技术对3D打印多孔钛合金假体表面的促成骨改性作用,为将来光功能化技术在骨骼修复融合领域的应用提供了理论依据。
3D打印多孔钛合金内植物在骨缺损修复重建中的重要作用已得到临床验证,但鉴于钛合金的金属惰性,其骨整合性能仍有待进一步提高。表面改性或可增加钛合金内植物的骨整合性能,但目前尚缺乏理想的实用性改性技术。在复习相关文献并不断探索的基础上,研究团队设计了一种基于紫外(UV)光功能化的全向照射仪,用于3D打印多孔钛合金内植物的表面处理,并证实了其体外及体内促成骨作用,同时对相关机制进行阐述。

全方位光功能化照射仪。黑色箭头表示3D打印多孔钛合金内植物。白色箭头与红色箭头均表示紫外线光源。
紫外光处理后,多孔 Ti6Al4V 支架的亲水性、细胞相容性和碱性磷酸酶活性显著提高,而其原始力学性能依然得到保持。利用体内兔髁突缺损模型的实验研究进一步证实了紫外光增强骨整合的作用,该模型观察结果表明,紫外线处理后通过增加骨生长(BI)、骨植入接触比(BICR)和矿化/类骨骨比提高了多孔Ti6Al4V 支架骨整合的效率。相信上述研究结果将具有的较强的临床转化潜力与较高的临床应用价值。
研究团队主体由北京大学第三医院骨科、北京爱康医疗器械公司及北京大学工学院等多家单位组成,自2010年开始对3D打印技术在骨科领域的应用展开系列性探索及研究,先后研发出三大系列应用于关节及脊柱外科手术的3D打印钛合金微孔结构内植物产品,于2015-2016年在国内上市,成为中国首批国家药监局注册的3D打印骨科产品。上述产品目前已在国内广泛应用并获得满意疗效,同时团队研发应用定制化3D打印钛合金内植物成功创造多个“世界首例”,使中国骨科在3D打印技术骨科临床应用领域走在世界前列。
随着研究的不断深入,团队在继续设计、研发新型产品的同时,逐渐将3D打印钛合金微孔假体通过表面改性及载药等技术手段使之达到成骨活性化和治疗功能化作为研究目标,力求通过多学科交叉融合性研究、基础与临床转化性研究,应用具有可靠成骨性能和所需治疗功能的3D打印钛合金微孔假体提高骨缺损,尤其巨大骨缺损的修复治疗水平。
北京大学第三医院刘忠军教授为该论文的通讯作者,尹川博士、张腾博士为该论文的共同第一作者。上述研究得到了中华人民共和国科技部重点研发计划、北京市科技委员会、北京-清华生命科学中心博士后基金以及北京AKEC医疗有限公司的资助。
原文链接https://www.sciencedirect.com/science/article/pii/S2452199X21002632?via%3Dihub="
田耘教授团队制备一种可以在脊柱手术中实现硬脊膜免缝合修复的新型生物密封剂
2022年2月,北京大学第三医院田耘教授团队在Materials science, Biomaterials(生物材料科学)领域排名第一的Bioactive Materials杂志正式出版了题为“High efficacy of tetra-PEG hydrogel sealants for suturelessdural closure”的论著,阐述了一种基于四聚乙二醇(PEG)的新型水凝胶密封剂,它具有操作简便、安全性高、凝固时间快、易于注射、良好的机械强度和强大的组织粘附力等优点,可在脊柱手术过程中实现有效的免缝合硬脊膜修复。
研究团队从临床实际需求出发,创新性制备出了一种新型聚乙二醇(PEG)水凝胶,可以通过共价键与硬脊膜表面的蛋白质形成稳定的酰胺键连接,在术中有效封堵硬脊膜的损伤。体外实验证实了其具有良好的细胞相容性和生物安全性,且即便在水环境下仍可以原位成胶,实现水密修复,并可承受远大于正常脑脊液压力的强度。
此外,还建立了新西兰大白兔硬脊膜缺损模型,通过MR、大体尸检、组织学染色和免疫组化等手段证实了其体内可以有效防止脑脊液漏的发生并促进硬脊膜的修复再生,为脊柱术中硬脊膜修复提供一种切实可行的新型治疗方案。
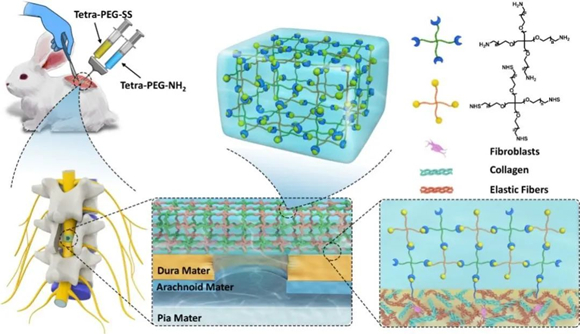
本研究创新性制备出了一种新型PEG水凝胶,术中操作简便,可直接通过双管注射器在硬脊膜损伤区域注射后原位成胶,并与硬膜表面的胶原蛋白和弹力纤维蛋白形成牢固的共价键链接,快速稳定地提供水密修复效果。
北京大学第三医院田耘教授和中国科学院化学研究所王星副研究员为该论文的通讯作者,北京大学第三医院祝腾蛟博士为该论文的第一作者。上述研究工作得到了国家重点研究发展计划-政府间国际科技创新合作重点专项、国家自然科学基金及中科院青年创新促进会支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2452199X2100308X
(北医三院)
编辑:玉洁


