罗建沅团队发现蛋白质去琥珀酰化酶SIRT5在丝氨酸代谢中的重要作用
2017年11月28日,北京大学基础医学院罗建沅教授课题组在《Cancer Research》在线发表题为“SHMT2 desuccinylation by SIRT5 drives cancer cell proliferation”的研究论文,首次报道了SIRTUIN家族成员SIRT5蛋白通过对线粒体丝氨酸羟甲基转移酶(SHMT2) 的去琥珀酰化修饰调控癌细胞内丝氨酸代谢以及一碳循环,为阐释癌细胞如何进行丝氨酸的过度利用以维持自身迅速增殖提供了重要线索。罗建沅教授为该文通讯作者,其直博研究生杨鑫为第一作者。
SHMT2是一种磷酸吡哆醛(PLP)结合蛋白,它催化丝氨酸与四氢叶酸反应产生5,10-亚甲基四氢叶酸和甘氨酸,为嘧啶的从头合成提供重要原料。最近的研究表明,丝氨酸分解代谢能驱动一碳循环进行,一碳循环的多种中间产物能够在核苷酸生物合成、维持细胞内氧化还原稳态以及癌细胞生长中起重要作用。而SHMT2作为关键蛋白能够调节丝氨酸分解代谢和一碳循环,敲低SHMT2表现出明显的对癌细胞生长和侵袭抑制。
SIRT5属于SIRTUIN家族,是一种NAD依赖的赖氨酸去乙酰化酶,并同时具有去琥珀酰化酶、去丙二酰化酶和去戊二酰化酶的活性,能调节多种细胞代谢途径,包括氨相关代谢、脂肪酸氧化和糖酵解等。但是SIRT5在非必需氨基酸代谢中的功能仍然不明确。
本研究中,课题组纯化出SIRT5相关的蛋白质复合体,并用质谱鉴定出大量的SIRT5底物,总结出多条未知的与SIRT5相关的代谢通路(如糖基化,代谢物转运等)。进一步的研究发现,SIRT5在丝氨酸分解代谢中起到不可替代的调控作用。本研究通过生物化学实验确定了SHMT2作为SIRT5去琥珀酰化底物,SHMT2第280位的赖氨酸被鉴定出是主要的琥珀酰化位点。SHMT2在低琥珀酰化修饰情况下,其生物学催化活性明显升高。在丝氨酸甘氨酸饥饿情况下,SIRT5与SHMT2直接作用,使其280位赖氨酸去琥珀酰化,从而促进SHMT2有催化活性的四聚体产生,而上调其酶活性。SHMT2失活的单点突变K280E细胞系表现出丝氨酸代谢阻断以及甘氨酸积累的特性,不仅损害癌细胞中氧化还原稳态,也能直接抑制癌细胞在细胞模型或小鼠模型中的生长(如图所示)。
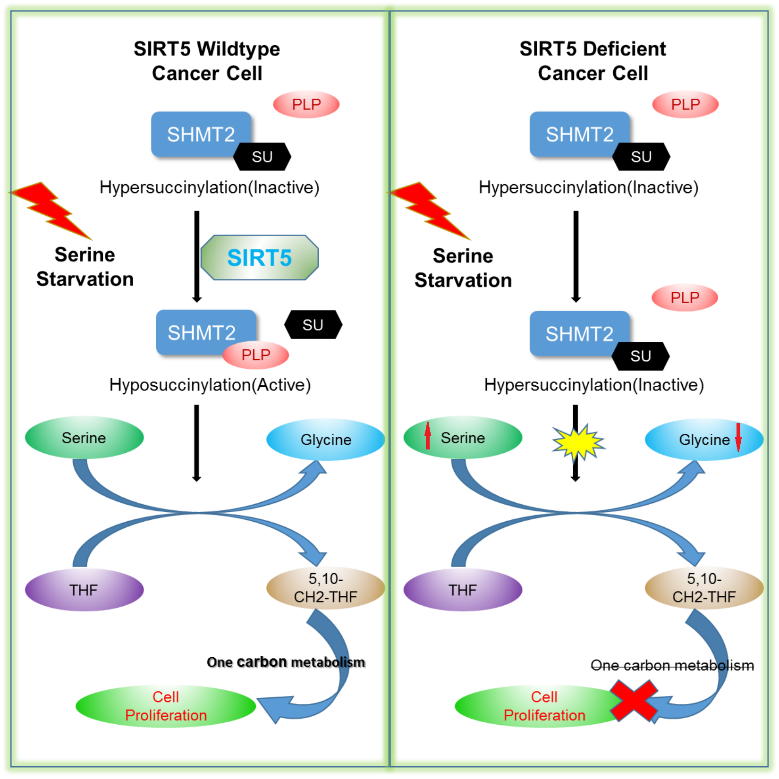
综上所述,SIRT5通过控制SHMT2的琥珀酰化修饰调节癌细胞增殖,不仅加深了对于线粒体SIRTUIN蛋白功能的了解,也为探索癌症治疗提供了新的思路,为开发新药提供了新的靶点。该研究项目得到国家自然科学基金、国家重点基础研究发展计划(973计划)的支持。
论文链接: http://cancerres.aacrjournals.org/content/early/2017/11/23/0008-5472.CAN-17-1912.article-info
(基础医学院)
编辑:玉洁


