邵一鸣教授团队通过恒河猴模型证明CTL免疫治疗可抑制抗HIV停药后的病毒反弹
2019年5月21日,国际著名综合性学术期刊《Nature Communications》以研究长文的形式在线发表论文“CTL-mediated immunotherapy can suppress SHIV rebound in ART-free macaques”。北京大学基础医学院病原生物学专业博士生范瑾为该论文第一作者,北京大学基础医学院病原生物学系兼职教授、中国疾病预防控制中心艾防中心邵一鸣教授和美国安德森癌症研究中心Cassian Yee研究员为该论文的共同通讯作者。该研究获得了国家“十二五” 重大专项“艾滋病和病毒性肝炎等重大传染病防治” 科技重大专项资助。
艾滋病是威胁人类健康的头号传染性疾病。由于抗艾滋病病毒(HIV)药物的重大突破和全球推广抗HIV 免费治疗,艾滋病的病死率已从超级癌症的高位下降到类似高血压等慢性病的水平。但研究显示「1」,全球有38 个国家到2020 年将无力承担高达42 亿美元的抗HIV 药物治疗费用。国际共识认为,实现艾滋病功能性治愈,即将终身治疗转变为阶段性治疗,是当前亟待解决的可持续治疗战略问题。
邵一鸣教授领衔的北京大学、中国疾病预防控制中心和国际学者合作团队,建立了抗病毒合并免疫治疗的SHIV 恒河猴模型,探索抗病毒停药后新型过继性免疫治疗,以寻找抑制病毒反弹的有效治疗策略。研究结果显示:在使用HIV 疫苗诱导细胞免疫反应峰值时分离并诱导分化的CD8+T 细胞,可在1 周内降低或完全抑制停药后的病毒反弹,免疫效果显著的猴子可持续2 个月以上维持血浆病毒载量处于检测水平之下。他们在进一步机制研究中发现,免疫抑制效果与回输细胞中抗HIV-1 Env 基因表位的CTL 应答存在剂量依赖关系。病毒反弹被完全控制猴子体内的Env 特异性CD8+ T 细胞的多功能反应(p <0.0001)、杀伤能力(p="0.0001)、活化水平(p< 0.01)和Tcm 分化程度(p=0.038)均显著强于病毒反弹一过性受控动物。敲除上述具有良好免疫抑制效果猴子体内的CD8+T 细胞,可使血浆内病毒载量迅速反弹至免疫治疗前水平,从而证实CD8+T 细胞介导了免疫治疗中病毒载量的控制。
该研究首次在抗病毒与免疫联合治疗的恒河猴模型,证明HIV疫苗诱导的CTL 过继性免疫治疗,可以控制抗病毒治疗停药后的病毒反弹。该研究为艾滋病功能性治愈研究提供了一种新的策略。
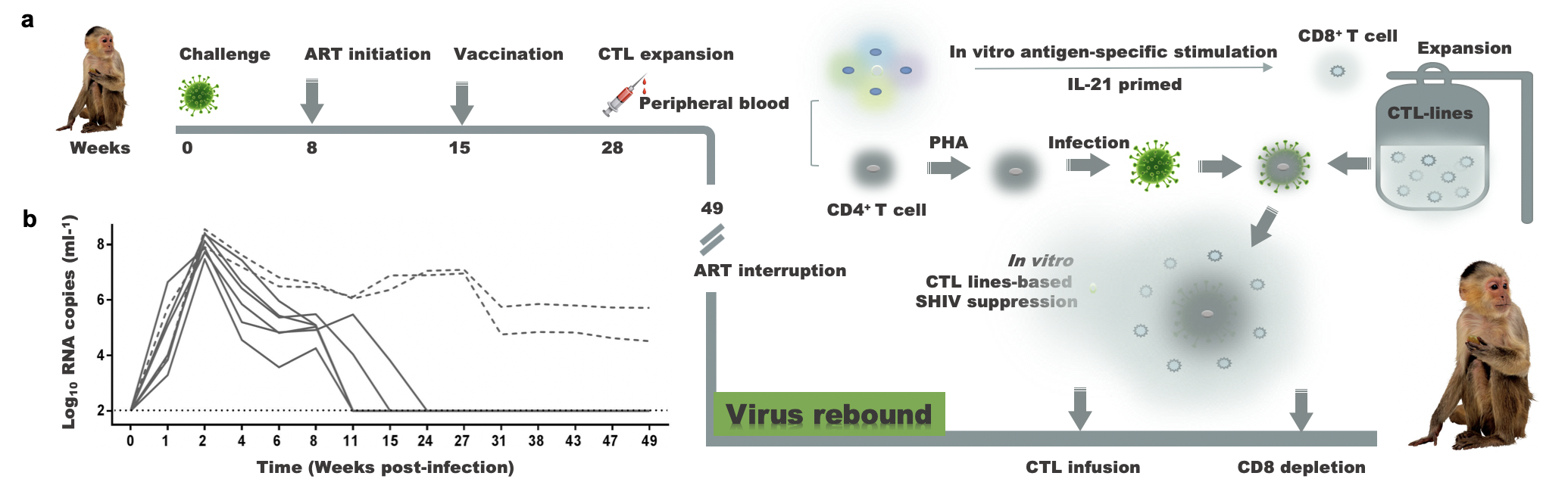
图1 实验设计和主要干预策略
a 实验设计. b 抗病毒治疗停止前SHIV-SF162P3的感染恒河猴血浆病毒RNA水平(检测敏感度 每ml 2 Log RNA 拷贝)。
原文链接: https://www.nature.com/articles/s41467-019-09725-6
参考资料:
「1」 Dutta, A., Barker, C. & Kallarakal, A. The HIV treatment gap: estimates of the financial resources needed versus available for scale-up of Antiretroviral Therapy in 97 countries from 2015 to 2020. PLoS Med. 12, e1001907 (2015).
(基础医学院)
编辑:玉洁


