于洋副研究员以并列第一作者身份在《细胞》杂志发表研究成果
2019年10月17日,北京大学第三医院生殖医学中心、临床干细胞研究中心于洋副研究员,与美国索尔克生物学研究所Juan Carlos Izpisua Belmonte教授,德克萨斯大学西南医学中心JunWu助理教授合作,在国际权威学术期刊《细胞》(Cell,影响因子36.216)在线发表研究成果“Generationof blastocyst-like structures from mouse embryonic and adult cell cultures”(“从小鼠胚胎及体细胞中产生囊胚样结构”)。这些培养的新型人造胚胎——“类囊胚”具有与自然受精囊胚相同的结构,甚至可以植入小鼠子宫中。这个新模型绕过了配子的使用,可以有效的回避人类自然受精胚胎研究中的伦理争议,对于以高通量方式揭示早期胚胎的发育机制,并构建机体各部分的类器官具有巨大潜力和应用价值。

受精囊胚植入子宫后可以发育成胎儿,但是这个过程很难研究。原因在于,动物模型(例如小鼠)只能产生少量的这些研究材料,科学家无法轻易地以高通量的方式探索各种因素对发育的影响。本研究中,体细胞先被重编程为诱导性多能干细胞(iPSC),然后将它们放入特殊的培养基中以扩充其发育潜力变成全能干细胞(EPS)。为了诱导EPS细胞形成类囊胚,研究人员将细胞培养在微孔板中,每个孔含有约五个细胞,模拟4-8细胞期的胚胎。这些小细胞团很快彼此形成连接(compaction),并开始极化(Polarization)。进一步,内外细胞开始分化,外层细胞开始激活YAP,YAP进入细胞核激活滋养外胚层相关的转录因子的表达,这些都是发育早期8-16细胞阶段胚胎经历的发育事件。类囊胚的形成模仿了自然的发育过程,这是已知的第一次在培养的细胞中系统性模拟这些重要的发育事件。
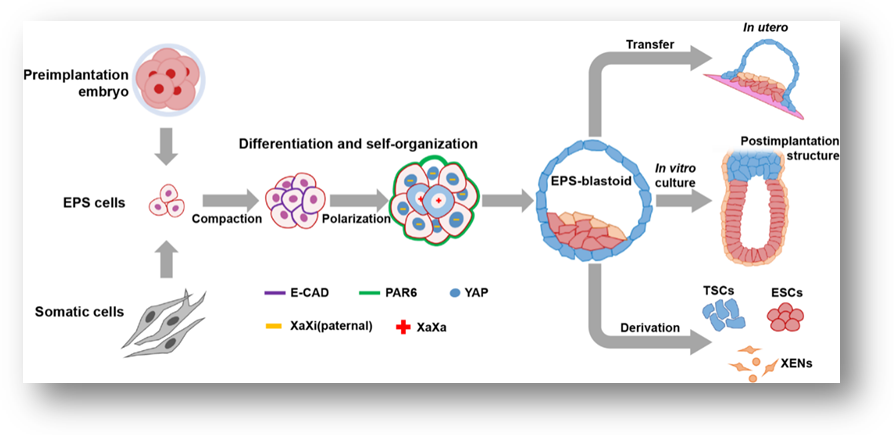
图例:受精胚胎和体细胞诱导形成的全能性干细胞(EPS)发生致密化后,形成极化胚胎,其外层细胞激活YAP蛋白和沉默父本X-染色体,最终产生一个类囊胚结构。这些类囊胚能作为获取三种干细胞的资源,在体外能够发育成植入后胚胎样结构,在体内可以完成子宫内植入过程。
类囊胚包含受精囊胚中具备的三种原始细胞类型。单细胞转录组测序分析显示类囊胚与受精囊胚有相似的基因表达特征。进一步实验证明,类囊胚可以在体外发育成类似于早期植入后胚胎的结构。然而,类囊胚在体内还不能发育成功能性胚胎。相反,移植到子宫后会长成结构混乱的组织。研究人员认为,通过进一步优化体系并结合基因编辑技术,能够获得功能更加完整的类囊胚,发育到形成不同器官原基的阶段,从而成为类器官的种子,可以用作器官移植的重要来源。
此项工作由中国国家重点研发计划(2016YFC1000601),G. Harold和Leila Y. Mathers慈善基金会,The Moxie基金会,Leona M.和Harry B. Helmsley慈善信托(2012-PG-MED002),Hewitt基金会,美国国立卫生研究院(5 DP1 DK113616)和西班牙圣安东尼奥?德?穆尔西亚天主教大学资助。
美国索尔克生物学研究所RonghuiLi,CuiqingZhong博士后及北京大学第三医院生殖医学中心/临床干细胞研究中心于洋副研究员为本文共同第一作者,美国索尔克生物学研究所Juan Carlos Izpisua Belmonte教授和德克萨斯大学西南医学中心JunWu助理教授为通讯作者。北京大学第三医院生殖医学中心闵喆莹博士对本研究亦有重要贡献。
本研究由多方研究人员密切合作完成。第一完成单位为美国索尔克生物学研究所,主要负责本项目中类囊胚结构的构建及体系优化工作;作为第二三完成单位的北京大学第三医院生殖医学中心和临床干细胞研究中心,主要负责本项目类囊胚基因表达特征图谱的绘制及植入后类囊胚发育特征的分析工作。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(19)31080-3
(北医三院)
编辑:玉洁


