北京大学基础医学院张宏权教授团队发现抑制Hippo信号通路的新机制
2019年 12月 10日,来自北京大学基础医学院的张宏权教授团队在 Cell Reports 杂志上在线发表题为 Kindlin-2 inhibits Hippo signaling pathway via promoting degradation of MOB1 的长篇研究论文。该研究发现整合素相互作用蛋白Kindlin-2能够通过促进MOB1的降解抑制Hippo信号通路,进而延缓肾纤维化的疾病进程。

Hippo信号通路在胚胎发育、肿瘤演变以及器官纤维化发生发展中均发挥重要作用。Hippo信号通路在进化上高度保守,其核心分子组成包括MST1/2、Salvador、LATS1/2、MOB1A/B以及YAP或TAZ。YAP作为转录共激活因子是控制Hippo信号通路靶基因的关键分子,YAP能否入核或入核的量决定了其与转录因子TEAD1-4结合并调控靶基因(如 CyR61 、 CTGF )的转录效率。对于YAP入核后的下游信号,已有大量的研究报道包括YAP调节发育、增殖、凋亡、干细胞的干性以及纤维化等生理病理过程。但是对YAP入核前如何受各种信号通路的调控,尤其是对Hippo信号通路的上游核心激酶LATS1的调控知之甚少。在本研究中,张宏权教授团队发现了一个整合素互作蛋白调控LATS1的激酶活性。该团队长期从事跨膜受体整合素信号及其相互作用蛋白的研究,其中整合素相互作用蛋白Kindin-2是Kindlins家族的成员之一,在整合素的激活中发挥重要作用。其前期研究结果发现Kindlin-2与Wnt、TGF-b及EGFR等信号通路中的关键分子存在着相互作用,进而在癌症、发育及纤维化的发生发展中起到重要作用。
已知MOB1是LATS1激活过程中的辅助因子,是LATS1完全激活所必需的。该团队发现Kindlin-2与Hippo信号通路的组成分子MOB1存在蛋白质之间的相互作用,并且抑制Hippo信号通路核心激酶LATS1的激活,促进Hippo信号通路的效应分子YAP的细胞核定位进而促进YAP下游靶基因 CyR61 和 CTGF 的转录。研究者首先发现Kindlin-2与Hippo信号通路的组成分子MOB1存在蛋白质之间的相互作用,并且抑制Hippo信号通路核心激酶LATS1的激活,促进Hippo信号通路的效应分子YAP的细胞核定位进而促进YAP下游靶基因 CyR61 和 CTGF 等的转录激活。有趣的是,Kindlin-2在肾小管上皮细胞中能够显著下调MOB1蛋白的表达量。进一步研究发现,Kindlin-2对MOB1蛋白降解的机制是通过与MOB1及其E3泛素连接酶praja2形成三分子复合物实现的,并且Kindlin-2是通过对MOB1的降解实现对LATS1激活的抑制作用。
肾纤维化是一个复杂的、不可逆的病理过程。Wnt,TGF-b和Hippo信号通路及Kindlin-2表达水平的改变共同参与肾纤维化。本研究发现在小鼠体内敲低Kindlin-2基因的表达可以有效激活Hippo信号通路,从而延缓肾纤维化的疾病进程。接下来,研究组通过对Kindlin-2基因敲除鼠进行单侧输尿管结扎手术(简称UUO,是一种常用的体外构建肾纤维化模型的手术方法)进一步在体研究Kindlin-2对Hippo信号通路的抑制作用。令人振奋的是,除了对Hippo信号通路有明显的抑制作用以外,Kindlin-2的低表达能够明显地降低肾纤维化标记物α-SMA和Fibronectin的蛋白表达,说明Kindlin-2的确通过抑制Hippo信号通路促进肾纤维化的发展。这些证据提示Kindlin-2可以作为肾纤维化治疗的靶点。为此,研究组进而使用特异性靶向Kindlin-2的长效siRNA对进行了UUO手术的肾纤维化野生型C57小鼠分别进行预防性给药(UUO术后当天开始给药)以及治疗性给药治疗(UUO术后7天后开始给药)实验,治疗实验结果表明特异性敲低Kindlin-2能够有效缓解UUO诱导的肾纤维化,甚至有一定的治疗意义。
实验最后,研究者在临床肾纤维化病人的组织中进一步证实了Kindlin-2与MOB1蛋白水平及与磷酸化YAP的负向相关关系。
结论:本项研究揭示了Kindlin-2抑制Hippo信号通路的新分子机制,并为临床肾纤维化的演进机制与临床治疗开辟了新的思路。
北京大学基础医学院博士后宋佳桂为本文的第一作者,张宏权教授和战军副教授为共同通讯作者。
张宏权教授团队近年来一直围绕整合素相互作用蛋白Kindlin-2进行了系列的研究工作,于Journal of Cell Bilolgy,Journal of TheAmerican Society of Nephrology,EMBO Reports等期刊发表近30余篇论文。本项研究代表了该方向的最新进展。
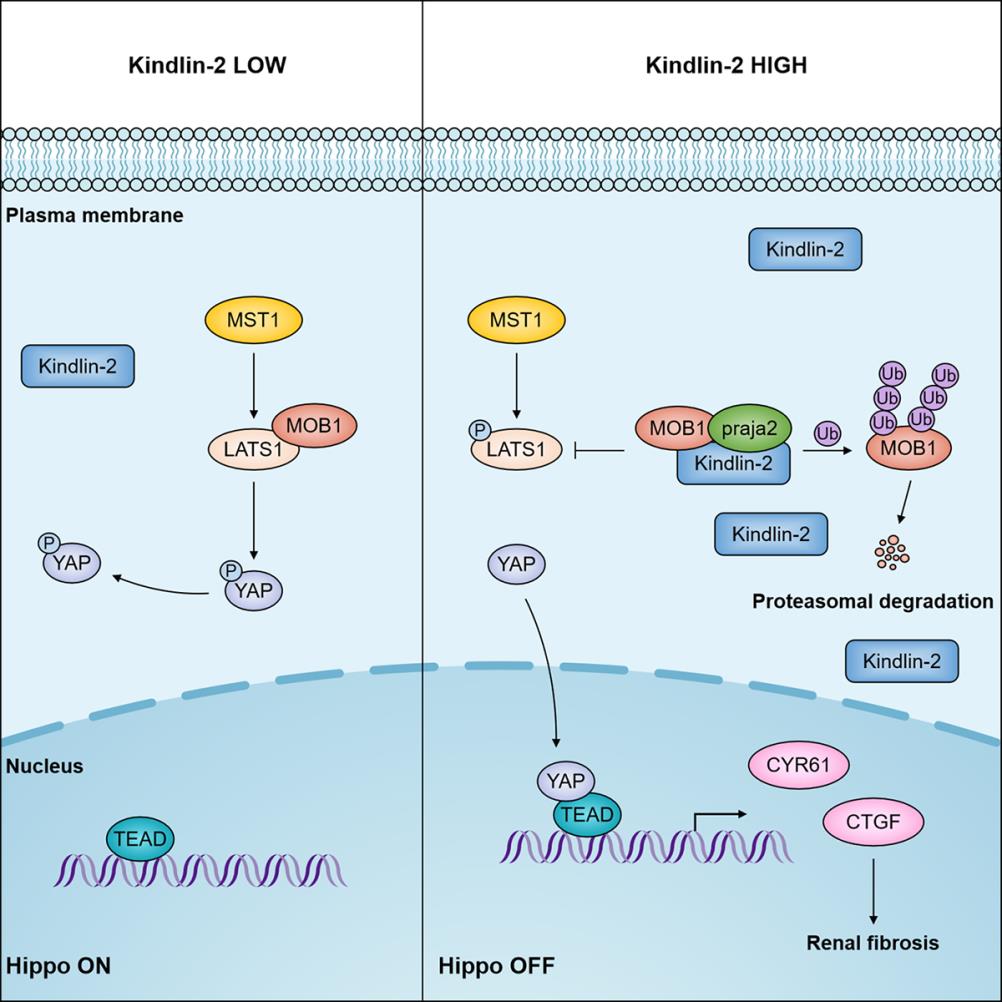
Working model: Kindlin-2 inhibition of Hippo/YAP signaling.
Left: Hippo/YAP signaling pathway in normal condition, MST1 phosphorylates MOB1 and LATS1. MOB1 is essential for fully activation of LATS1. Phosphorylated LATS1 interacts with and phosphorylates YAP, and phosphorylated YAP tends to be degraded. Increased Kindlin-2 promotes the interaction between MOB1 and E3 ligase praja2 praja2, which promotes the degradation of MOB1. LATS1 was then inactivated and non-phosphorylated YAP transfers into nucleus to promote the transcription of target genes CTGF and Cyr61and renal fibrosis progression.
(基础医学院)
编辑:玉洁


