药学院刘涛团队在《Nature Chemical Biology》上发表最新研究成果
2021年11月15日,药学院刘涛研究员团队在化学生物学领域顶级期刊Nature Chemical Biology(IF="15.0)在线发表了最新研究成果“Genetic code expanded cell-based therapy for treating diabetes in mice”。
近年来,随着CAR-T细胞的成功上市,利用合成生物学设计的细胞治疗方式已显现出广阔的疾病治疗前景。其基本原理是在细胞中装配药物靶点调控开关,在外源刺激信号作用下,细胞调控靶蛋白的合成。将细胞治疗系统应用于糖尿病,可以通过口服小分子作为外源刺激信号调控胰岛素表达,避免胰岛素注射所带来的痛苦。然而,当前的细胞治疗策略很难实现快速的信号调控,这限制了其在需要及时干预的疾病(如糖尿病)中的应用。其中,最主要的原因是缺乏快速调控的合成生物学工具。当前的调控工具主要集中于转录因子介导的转录水平调控,调控过程复杂,蛋白表达时间缓慢。
针对这一问题,刘涛团队利用基因密码子扩展技术开发了非天然氨基酸调控的胰岛素细胞治疗系统(Noncanonical Amino acids (ncAAs)-triggered Therapeutic Switch, NATS),越过转录调控,直接在翻译水平快速调控蛋白质表达(如图)。该研究补充了合成生物学中的蛋白调控开关工具库,也为基因密码子扩展技术的应用创新提供了新的思路。
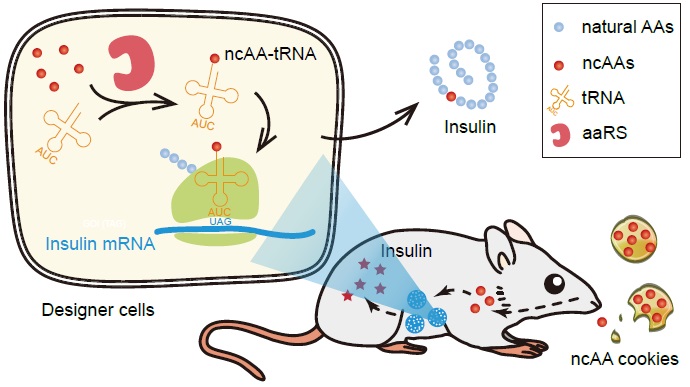
NAST系统在翻译水平快速调控蛋白表达
基因密码子扩展技术通过能够识别ncAA的氨酰tRNA合成酶和tRNA分子对,通读mRNA的异位琥珀密码子,将ncAA插入蛋白质,该技术已成为重要的蛋白质定点修饰技术。刘涛团队将ncAA氨酰tRNA的蛋白质翻译机制整合到哺乳动物细胞基因组,构建了翻译水平可逆调控胰岛素表达的工程细胞系。利用细胞包埋技术,研究人员为NATS细胞包裹选择性透过膜后移植到小鼠体内,使得移植的细胞可以获得营养分子,而避免小鼠免疫细胞的攻击。通过口服ncAA,小鼠可以获得ncAA剂量依赖的目的蛋白表达。糖尿病小鼠口服一次ncAA后,在90分钟内即可明显降低血糖。糖尿病是需要终身用药的慢性疾病。
为证明NATS系统的长期治疗效果,研究人员开展了为期一个月的药效和毒性实验。结果表明,移植了NATS细胞的糖尿病小鼠可以获得持续的胰岛素表达和血糖控制,而且没有观察到体重和生理生化指标的异常。该研究将基因密码子扩展技术应用于细胞治疗领域,弥补了传统的转录水平调控工具的不足,为糖尿病的细胞治疗策略提供了新的思路。

左起:黄雨佳,刘涛研究员,陈超,叶海峰研究员
北京大学博士生陈超、黄雨佳和华东师范大学博士生余贵玲为该论文的共同第一作者,刘涛研究员和华东师范大学生命科学学院叶海峰教授为共同通讯作者。该研究的药代动力学实验获得了北京大学药学院孙懿老师的帮助。该研究获得北京市杰出青年基金、国家自然科学优秀青年基金、国家“重大新药创制”专项、科技部合成生物学重点专项、上海市科委合成生物学重大项目、深圳合成生物学创新研究院对外开放基金等项目的支持。
论文链接:https://www.nature.com/articles/s41589-021-00899-z
【延伸阅读】刘涛研究员简介:

刘涛 北京大学药学院研究员,博士生导师,分子与细胞药理系主任,天然药物及仿生药物国家重点实验室PI,北京大学化学生物学交叉中心PI。获北大百人、中组部高层次引进青年人才、国家优青、北京市杰青等项目资助。任中国医药生物技术协会委员合成生物学分会委员,中国生物医学工程学会青工委委员,获中国药学会-以岭生物医药青年奖,北京大学拜耳研究员奖及王选青年学者奖。以通讯作者身份在Nature ChemBiol,Mol Cell,SciAdv,JACS,Angew. Chem. Int. Ed.等期刊发表科研论文近20篇。担任Chin Chem Lett青年编委,Frontiers in Chemistry编委,Journal of Molecular Biology客座编委等。研究集中在蛋白质定点修饰技术,发展了含有人造氨基酸的蛋白质创新药物,应用在肿瘤及基因治疗等多种领域,从而促进了生物药物的升级换代。
(药学院天然药物及仿生药物国家重点实验室)
编辑:玉洁


