北大口腔多单位合作 周永胜/施松涛团队首次系统表征了间充质干细胞来源的凋亡囊泡
近日,北京大学口腔医院周永胜教授团队、中山大学华南颅颌干细胞转化研究中心施松涛教授团队合作的研究成果发表在细胞外囊泡领域的顶级期刊《细胞外囊泡杂志》(《Journal of Extracellular Vesicles》)。该研究首次系统表征了间充质干细胞来源的凋亡囊泡的详细特征、特定表面标记物和生物学特性,并首次阐明了其活化血小板、治疗血友病A的作用和机制。
细胞凋亡是一种细胞程序性死亡,是机体为了更好地适应生存环境而主动完成的死亡过程。人体每天都会有大约2000亿个细胞完成更新,以维持内环境稳态。在细胞凋亡过程中,细胞会经历一系列的生物学变化,最终分泌出大量含有蛋白质、DNA、RNA、脂质和代谢物的凋亡囊泡(apoVs)。间充质干细胞(MSCs)是具有自我更新和多向分化能力的非造血干细胞。基于MSCs的细胞疗法在多种疾病的治疗中都显示出广阔的应用前景,例如骨质疏松症、糖尿病等。近年来的研究证实,在多种疾病模型中,MSCs来源的apoVs能够发挥优于MSCs自身的治疗效果。外源性输注的apoVs能够通过挽救内源性MSCs的干细胞特性来改善骨质减少、抑制多发性骨髓瘤细胞生长并减轻骨髓瘤骨病、通过恢复肝巨噬细胞稳态来对抗2型糖尿病等。然而,MSCs来源的apoVs的详细特征、特定标记物和生物学特性尚不完全清楚,阻碍了apoVs的深入研究和转化应用。
鉴于此,课题组首次针对MSCs来源的apoVs展开了系统研究。在本研究中,通过各种方法对源自三种不同类型MSCs的apoVs进行了详细表征,以识别它们的形状、大小、密度、表面分子特征和蛋白质含量等。通过定量蛋白质组学和生物信息学分析,本研究建立了MSCs来源的apoVs的独特蛋白质图谱,并确定了apoVs和外泌体在功能性蛋白和表面标志物方面的差异。此外,与外泌体相比,该研究鉴定了apoVs中特异性高表达的13种功能蛋白,这些蛋白可用作apoVs特异性生物标志物。
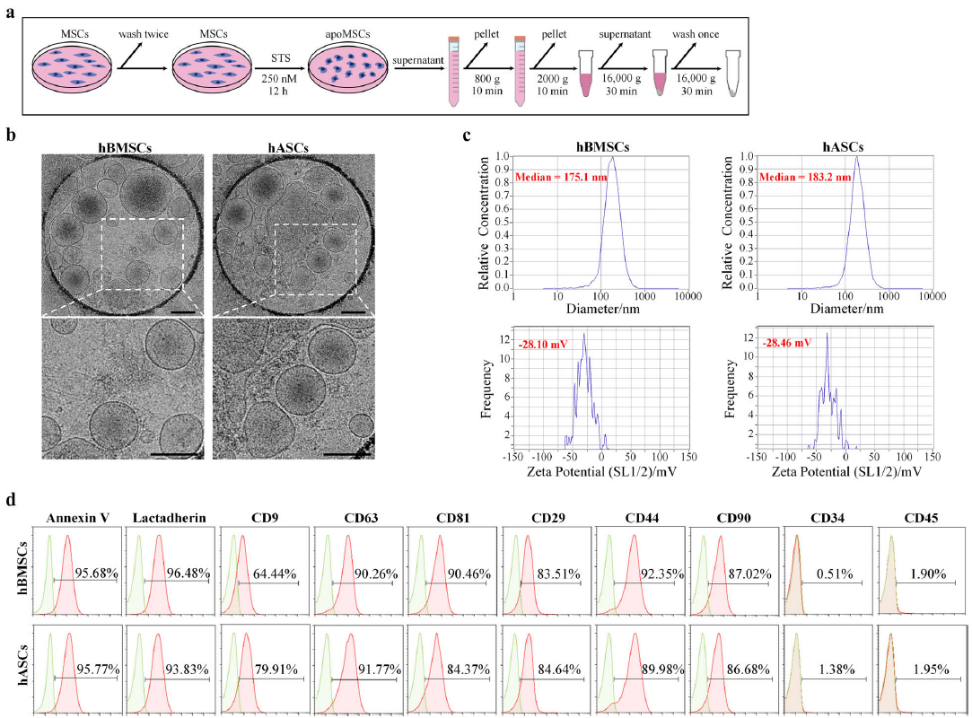
间充质干细胞(MSCs)来源的凋亡囊泡(apoVs)的特征
更有趣的是,该研究还发现apoVs继承了Fas等亲代细胞的凋亡印记,通过与血小板的FasL结合以激活血小板功能,从而改善凝血因子VIII敲除小鼠的A型血友病症状、挽救凝血障碍。这是国内外首次将细胞外囊泡应用于治疗血友病的尝试,为相关出血性疾病的治疗提供了新的思路,未来有可能开发基于apoVs的血友病疗法。总之,本研究首次系统表征了MSCs来源的apoVs的生物学特征,为apoVs的研究奠定了坚实基础,并首次阐明了apoVs通过Fas/FasL联动机制激活血小板、纠正凝血障碍的生物学功能,提示了apoVs在血友病A治疗中的潜在应用前景。
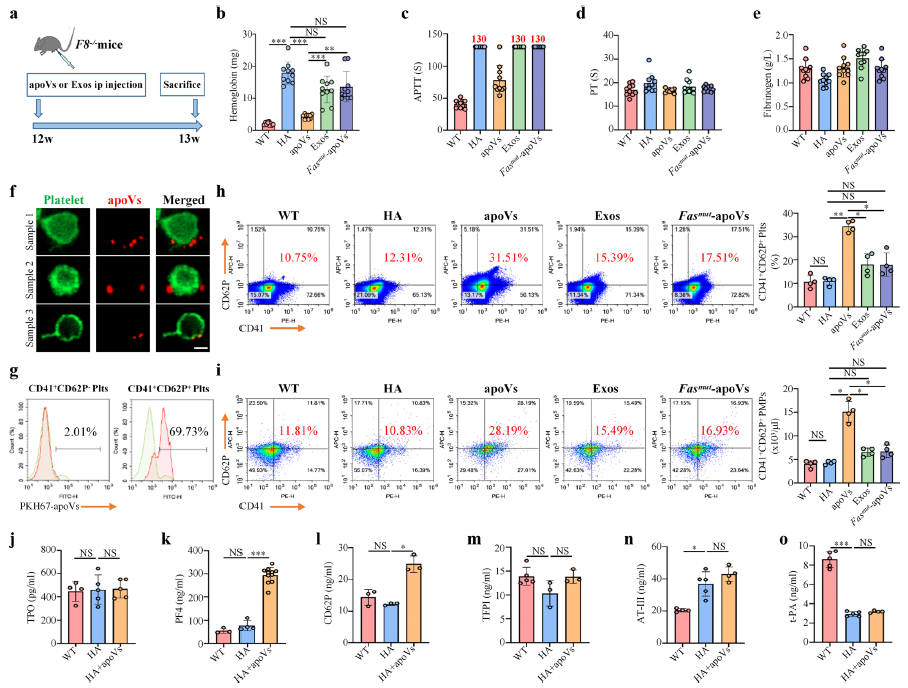
MSCs来源的apoVs激活血小板功能,挽救血友病A小鼠的凝血障碍
北京大学口腔医院修复科张晓和中南大学湘雅口腔医院唐健霞为本文的共同第一作者,北京大学口腔医院修复科周永胜教授和中山大学华南颅颌干细胞转化研究中心施松涛教授为共同通讯作者。该研究受到国家自然科学基金、北京市自然科学基金等资助。
周永胜教授课题组的主要研究方向是口腔颌面部组织再生和修复,尤其是在干细胞生物学、胞外囊泡生物学、生物材料和数字化修复等方面取得大量原创性成果。在国际权威期刊,如Journal of Extracellular Vesicles,Nano Today, Nano Energy, ASC Nano, Biomaterials, Bioactive Materials, Small, EMBO reports等发表论文150余篇,在中文期刊发表论文110余篇,另外获批国家专利50余项。周永胜教授以第一完成人荣获中华口腔医学会科技奖一等奖1项、北京市科学技术奖3项,负责国家重点研究计划项目、国家自然科学基金(含重点项目)、国家临床重点专科建设项目和省部级项目20余项。周永胜教授基于长期优秀的科技创新和成果转化,入选长江学者等国家级重大人才项目。
文献链接:
http://dx.doi.org/10.1002/jev2.12240
(来源:口腔医院)


