Cell杂志发表北大医学合作团队重要研究成果 ——发现菌源胆汁酸的全新修饰类型及生物合成通路,是脂肪性肝炎防治的新策略
肠道微生物与宿主之间互惠共生,密不可分,定植在宿主体内的共生微生物可以通过多种机制影响宿主生理与病理生理功能。其中,胆汁酸是沟通宿主与肠道微生物的关键信使分子。初级胆汁酸,如:胆酸(CA)和鹅去氧胆酸(CDCA)在人体肝脏中合成而来,并经由胆囊进入肠道,被肠道微生物代谢为脱氧胆酸(DCA)、石胆酸(LCA)等次级胆汁酸。胆汁酸可以通过调控法尼醇X受体(FXR)、胆汁酸G蛋白偶联受体5(TGR5)、维生素D受体(VDR)等宿主受体,在宿主糖脂代谢、免疫应答等多个生理与病理生理过程中发挥关键作用,因而受到了研究人员的广泛关注。然而,目前肠道微生物对胆汁酸的修饰类型还有待挖掘,不同胆汁酸与疾病调控的分子机制尚不明确,菌群胆汁酸代谢的生物合成通路解析仍是该领域的重点与难点。

https://www-cell-com-443.webvpn.bjmu.edu.cn/cell/fulltext/S0092-8674(24)00350-7#%20
2024年4月22日,北京大学医学部基础医学院姜长涛教授团队、北京大学第三医院乔杰院士团队、北京大学第三医院庞艳莉团队、北京大学医学部药学院贾彦兴团队与合作者,在Cell杂志在线发表了题为“Gut symbionts alleviate MASH through a secondary bile acid biosynthetic pathway”的研究论文,构建了基于点击化学富集策略结合非靶向代谢组学方法的次级胆汁酸挖掘体系,发现肠道菌群对胆汁酸的全新修饰类型—3-酰基化修饰;通过分离培养建构肠道菌株库及大规模筛选,研究团队发现单形拟杆菌(Bacteroides uniformis)是3-琥珀酰胆酸(3-sucCA)主要的肠道菌来源;通过基于活性的蛋白追踪纯化策略,研究团队挖掘出3-sucCA合成酶——“BAS-suc”。最后,临床队列提示3-sucCA与代谢相关脂肪性肝炎(MASH)进程呈显著的负相关性。研究团队深入解析了3-sucCA在代谢性疾病的保护作用与分子机制,发现其通过菌群重塑—促进益生菌嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)的生长,改善肠屏障损伤,降低慢性低水平炎症,从而逆转小鼠的MASH表型。该研究为未来临床治疗代谢相关脂肪性肝炎(MASH)等代谢性疾病的潜在药物开发提供了基础研究,为菌源胆汁酸的生物合成研究提供了新的方向,同时也为调控疾病的肠道菌源酶挖掘研究提供了新范式。。
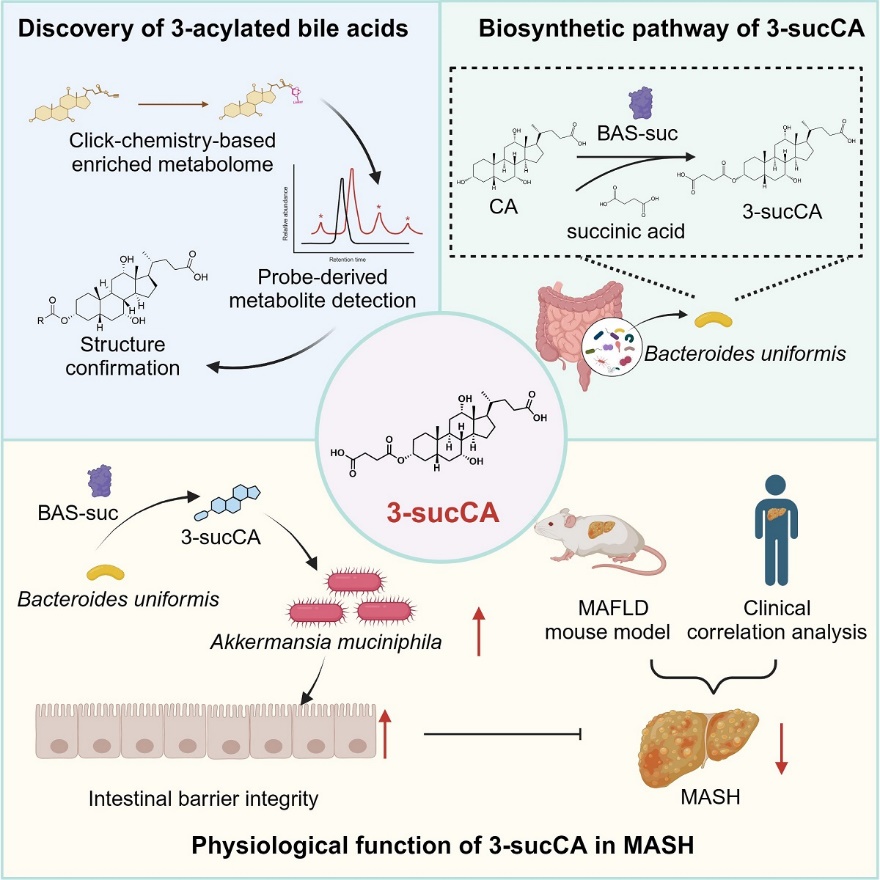
图1. 3-sucCA的发现,生物合成通路及其对MASH的改善作用
研究团队基于点击化学的原理,建立了一套菌源胆汁酸挖掘体系,利用该挖掘体系,研究团队通过分子网络分析发现了一系列包含酰基化的新型菌源胆汁酸。通过大规模粪便菌群发酵液分离与化学合成比对,研究团队在胆酸所包含的3个可发生酰基化反应的羟基位点(3位、7位、12位)中,确认所有的新型菌源胆汁酸其酰基化位置都发生在3位上。最后,研究团队在菌群、小鼠、人群三个维度系统地检测了新型胆汁酸的丰度及流行率,这些酰基化胆汁酸广泛存在,可能存在一定的生理作用。在评估新型胆汁酸的丰度及流行率过程中,3-琥珀酰胆酸(3-sucCA)在健康志愿者粪便样本中表现出了最高的丰度与流行率。为探索3-sucCA的主要肠道菌来源,研究团队收集了3-sucCA丰度最高的健康志愿者的粪便样本,通过分离培养建构肠道菌株库、大规模菌株筛选、小鼠定植检测实验确认了单形拟杆菌(Bacteroides uniformis)在体外或体内都存在3-sucCA合成能力。
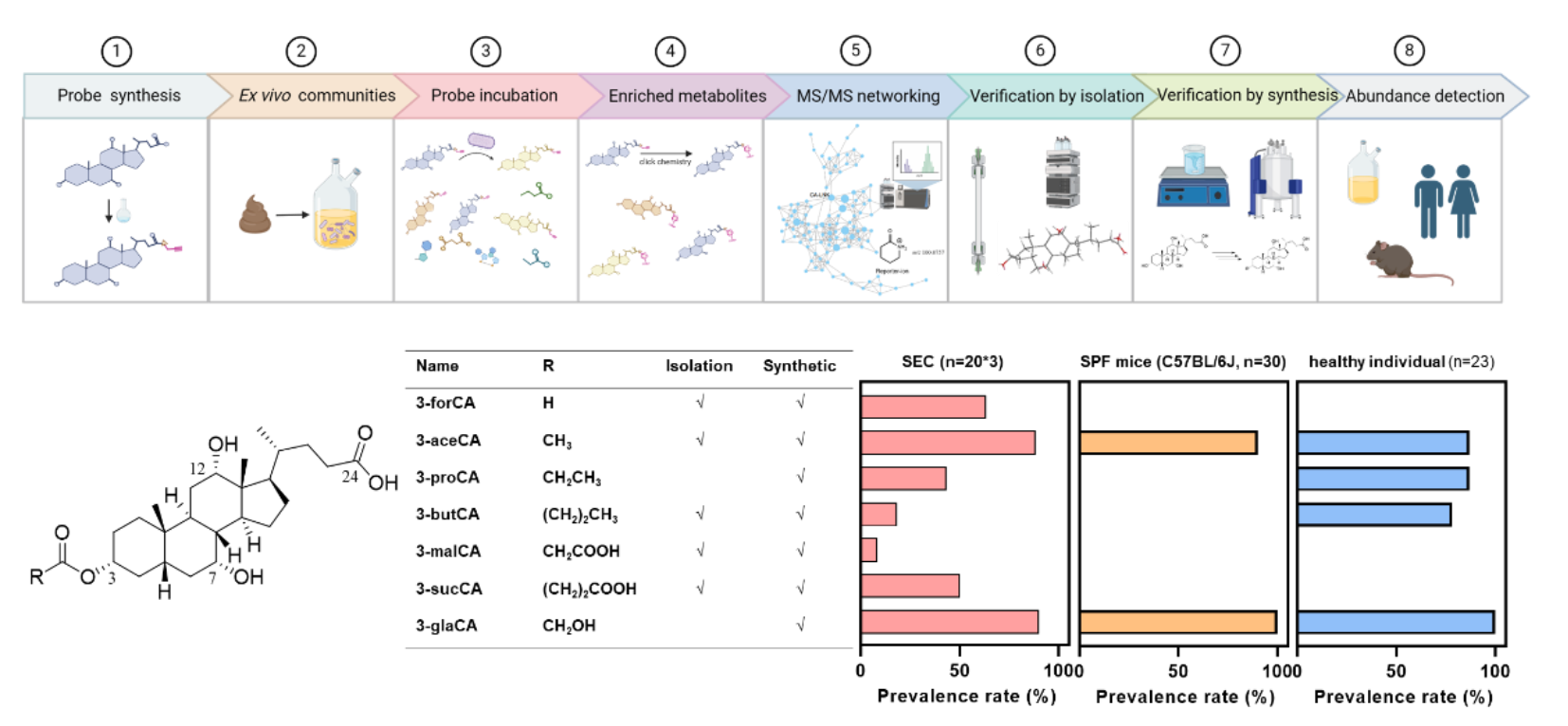
图2.菌源胆汁酸挖掘体系与3-酰基化胆汁酸结构
为探索单形拟杆菌中负责3-sucCA生物合成的关键酶,研究团队通过大肠杆菌过表达实验检验了单形拟杆菌中所有的16种注释为酰基转移酶的基因,然而这些候选基因都没有产3-sucCA的活性。接下来,研究团队以单形拟杆菌裂解液粗酶反应为基础,通过基于活性的蛋白纯化与鉴定方法,逐步根据裂解液>80%硫酸铵蛋白沉淀> 疏水相互作用色谱(HIC)> 离子交换色谱(IEC)层层纯化,最终利用蛋白质谱分析揭示出118个候选蛋白。团队通过异源表达实验将以上118个蛋白全部进行一一验证,发现只有过表达一个被注释为β-内酰胺酶的蛋白A7UYF6可以使大肠杆菌获得产3-sucCA的能力。进一步地,研究团队通过基于CRISPR-Cas系统的厌氧菌基因敲除实验、近缘同属菌株过表达实验、以及纯酶体外酶促实验验证了该酶负责3-sucCA的生物合成,并将该酶命名为“BAS-suc”。

图3. 基于活性的蛋白纯化与鉴定发现3-sucCA合成酶
通过质谱成像技术(DESI-MSI)、体外生长曲线测定以及一系列动物实验发现:3-sucCA作为一种局限于肠腔的代谢物,可以通过重塑肠道菌群,尤其是促进嗜黏蛋白阿克曼氏菌(Akkermansia muciniphila)的生长,来改善MAFLD疾病中显著受损的肠道屏障,增加黏膜厚度及杯状细胞数量,进而阻碍MAFLD疾病进程。而敲除菌株的动物实验也说明:单形拟杆菌对MAFLD的改善作用完全依赖3-sucCA的生成。以上结果在临床队列中也得到验证,研究团队招募了55名经活检的MAFLD病人与21名对照人群队列,发现粪便中3-sucCA含量随着MAFLD疾病进程逐步降低,且与疾病相关指标(ALT/AST)等呈显著负相关。这些结果揭示了3-sucCA作为新型菌源胆汁酸通过菌群互作改善MAFLD的新范式。
北京大学医学部基础医学院博士后聂启兴、博士研究生罗茜、副研究员汪锴、博士后丁勇以及药学院博士研究生贾淑密为本文的共同第一作者。北京大学医学部基础医学院/北京大学第三医院医学创新研究院姜长涛教授、北京大学第三医院乔杰院士、北京大学第三医院庞艳莉研究员、温州医科大学附属第一医院郑明华教授以及北京大学医学部药学院贾彦兴教授是这一研究成果的共同通讯作者。本研究得到女性生育力促进全国重点实验室、血管稳态与重构全国重点实验室的大力支持,得到杰出青年科学基金、国家自然科学基金重大研究计划集成项目、重点项目、专项项目以及国家重点研发计划基金等经费支持。
【延伸阅读】作者简介:

姜长涛,北京大学长聘教授、博雅特聘教授,基础医学院副院长,免疫学系主任,国家杰出青年科学基金获得者、科学探索奖获得者。从事肠道共生菌与代谢性疾病的研究。首创“肠道菌源酶跨物种调控宿主稳态”新理论:提出菌源宿主同工酶的新概念,揭示菌源DPP4介导临床降糖药物响应性的分子机制,为靶向肠道菌群精准干预疾病开辟了全新方向;发现菌群—宿主互作的关键信使—胆汁酸的全新菌源修饰类型及生物合成通路,是脂肪性肝炎防治的新策略;首次发现了降解尼古丁的肠道共生菌及其在脂肪性肝炎发病中的关键保护作用。发现菌源BAS-suc、DPP4、NicX、BSH等多个代谢性疾病干预的新靶标及相应干预新策略。近5年在Cell(2024)、Science(2023)、Nature(2022)、Nature Microbiology(2024)、Nature Cardiovascular Research(2023)、Cell Metabolism(2021a, 2021b, 2019)、Nature Medicine(2019)等杂志发表SCI论文二十余篇,其中4篇入选高被引论文,1篇获F1000最高等级推荐,8篇得到国际知名学者推荐及同期评述,受邀在Nature Reviews Endocrinology、Cell Host & Microbe等期刊发表综述或述评10篇,入选Cell Metabolism杂志编委。获得2023年度中国生命科学十大进展、北京市自然科学一等奖(第一完成人)、中国青年科技奖、谈家桢生命科学创新奖等奖励;主持基金委重大研究计划集成项目、重点项目、专项项目、国家重点研发计划等十余项基金。
(北京大学基础医学院)
编辑:玉洁


