各+1!北大医学团队再发 Nature、Science
编者按
2025年作为“十四五”与“十五五”战略
衔接的关键节点
北京大学医学部以科技创新为核心驱动力
在医学创新战略版图上再添标志性成果
3月7日
基础医学院孔炜教授团队在《自然》(Nature)
揭示抗动脉粥样硬化新策略
药学院焦宁教授团队于《科学》(Science)
报道碳碳键断裂转化反应新突破
北大医学研究成果接连亮相全球顶级期刊
为北大医学攀登世界科技高峰
注入新的强劲动力
靶向神经酰胺受体-开辟降胆固醇以外的抗动脉粥样硬化新策略
动脉粥样硬化是引发心肌梗死、脑卒中等严重心血管事件的罪魁祸首,当前药物治疗策略主要以降低低密度脂蛋白-胆固醇(LDL-C)。尽管他汀等降脂药降低了约三分之一心血管不良事件的风险,仍有相当数量的患者,即使血脂水平已降至达标,却依旧面临着“残余风险”而发生不良心血管事件。尤其是慢性肾病(CKD)患者,随着肾功能逐渐衰退,通过降低胆固醇来预防心血管疾病的疗效逐渐减弱,在终末期肾病患者中几乎消失。寻找降胆固醇之外的抗动脉粥样硬化新策略,是目前国际上共同关注的焦点问题。

神经酰胺属于鞘脂类物质,由鞘氨醇链与不同长度的脂肪酸链经酰胺键连接而成。临床研究表明,循环血中的长链神经酰胺,如C16:0、C18:0和C24:1等,其水平能够独立于胆固醇预测心血管事件的发生风险,因此被形象地称为“第二胆固醇”。然而,循环中的长链神经酰胺如何加剧动脉粥样硬化性心血管疾病的发展?是否存在膜受体介导其致病信号传导?这一系列问题长期以来成为科学界亟待攻克的难题。2025年3月7日,由北京大学基础医学院、血管稳态与重构全国重点实验室孔炜教授团队牵头,联合北京大学基础医学院/山东大学孙金鹏教授团队、北京大学基础医学院姜长涛教授团队以及中日友好医院心脏科郑金刚教授团队,在国际顶尖学术期刊Nature线上加速发表了一项重要研究成果——“Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis”。
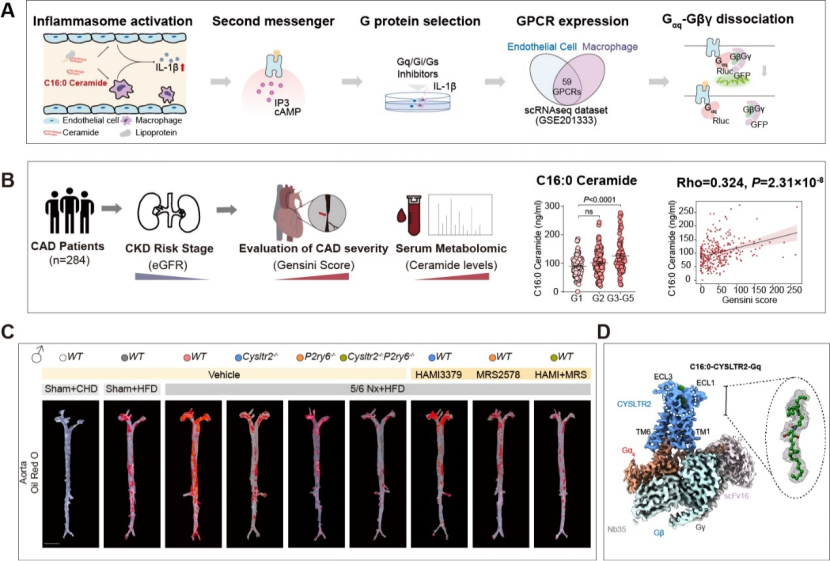
研究团队首次鉴定出神经酰胺C16:0的内源性膜受体为半胱氨酰白三烯受体2(cysteinyl leukotriene receptor 2,CYSLTR2)和嘧啶能受体P2Y6(pyrimidinergic receptor P2Y6,P2RY6)。当这两种受体识别神经酰胺后,会触发Gq蛋白的激活,进而引发炎症小体的活化,最终导致动脉粥样硬化斑块的形成显著加剧。动物实验显示,在不影响血脂水平的前提下,敲除相关受体或使用受体拮抗剂,能够有效阻断神经酰胺的致病效应。若同时阻断这两种受体,对减轻动脉粥样硬化斑块负荷的效果更为显著。
慢性肾病(CKD)会加速动脉粥样硬化进程。为了探究神经酰胺在慢性肾病加重动脉粥样硬化中的作用,研究团队收集并分析了不同肾功能分期的冠心病患者的血浆样本,证实了神经酰胺水平与冠脉病变程度之间存在独立相关性,而通过敲除受体或使用受体拮抗剂,在不干扰血脂代谢的情况下,能够有效逆转肾病加重的动脉硬化进程。这意味着神经酰胺有望成为慢性肾病合并冠心病的新型预警标志物,而干预其受体,可能阻断疾病进程。
此外,研究团队还成功解析了“神经酰胺C16:0-CYSLTR2-Gq”复合物的结构,明确了神经酰胺以非经典的斜插式方式与受体结合,为未来靶向神经酰胺受体的药物开发提供了重要蓝图。
此项研究成果具有重要意义,首次鉴定出神经酰胺的内源性受体CYSLTR2和P2RY6,全面揭示了神经酰胺通过激活受体、活化炎症小体,从而加重动脉粥样硬化以及慢性肾病相关动脉粥样硬化的分子机制,这一发现为破解脂质残余风险这一医学难题提供了全新的“解题思路”,靶向神经酰胺受体极有可能成为未来抗动脉粥样硬化治疗的关键突破口。
北京大学基础医学院博士生张思婷、山东大学口腔医学院博士后林慧、北京大学基础医学院博士后王佳乐、博士生芮婧钰,山东大学高等医学研究院博士生王腾威,北京大学基础医学院博士后蔡泽宇以及山东大学高等医学研究院副研究员黄深明为本文的共同第一作者。北京大学基础医学院为第一完成单位。北京大学基础医学院/血管稳态与重构全国重点实验室孔炜教授、北京大学基础医学院/山东大学孙金鹏教授、北京大学基础医学院姜长涛教授、中日友好医院心脏科郑金刚教授为本文通讯作者。该研究获得了科技部专项、国家自然科学基金委的支持。
原文链接:https://www.nature.com/articles/s41586-025-08792-8
孔炜
孔炜教授长期以来致力于血管微环境和重大心血管疾病的发病机制研究,揭示了血脂非依赖的动脉粥样硬化新靶点-基质水解酶ADAMTS-7,获得大规模人群研究验证,研发了基于ADAMTS-7的新型动脉粥样硬化疫苗,获得教育部自然科学一等奖和Circulation年度最佳基础/转化奖Joseph Loscalzo Award。应邀在心血管权威杂志上撰写血管基质微环境综述(Nature Review Cardiology, 2025),在European Heart Journal ,Circulation, Cell Research等杂志发表文章150余篇。
孙金鹏
孙金鹏教授长期致力于膜受体(GPCR等)对微环境的感知、配体发现、信号转导和功能多样性研究。提出了受体信号转导磷酸化编码的笛子模型,为受体功能多样性的机制提供了重要的理论基础;发现了多个受体的内源性配体,揭开了这些类固醇激素快速作用的膜受体疑云;阐明了受体对痒觉和力的感知机制,发现了多种有疾病治疗前景的GPCR人工配体。入选2023年中国十大科技进展,在Nature、Science、Cell等杂志发表文章90余篇。
姜长涛
姜长涛教授从事肠道菌群及其菌源酶与代谢性疾病的研究,形成“肠道菌源酶跨物种调控宿主稳态”新理论,提出“肠道菌源宿主同工酶”新概念,揭示菌源宿主同工酶在调节宿主代谢稳态、介导临床药物响应性方面的新功能;发现菌群与宿主互作的关键信使—胆汁酸的多种全新菌源修饰类型及生物合成通路,是代谢性疾病防治的新策略;揭示神经酰胺是器官间互作的关键介质,阐明多种菌源酶调节神经酰胺的新机制。获2024、2023年度中国生命科学十大进展、2023年度中国高等学校十大科技进展等奖励,近五年在Science、Nature、Cell等期刊发表论文30余篇。
碳碳键断裂转化反应新突破
3月7日,北京大学药学院/天然药物及仿生药物全国重点实验室焦宁研究团队在Science在线发表题为“Catalytic remodeling of complex alkenes to oxonitriles through C="C" double bond deconstruction”(通过碳碳双键解构实现复杂烯烃的催化重塑)的研究论文,报道了该团队在碳碳键断裂转化领域的最新研究成果。该研究通过设计合成非均相铜催化剂,实现了烯烃类复杂分子到羰基腈的转化,完成了药物、天然产物等复杂分子骨架的精准编辑。

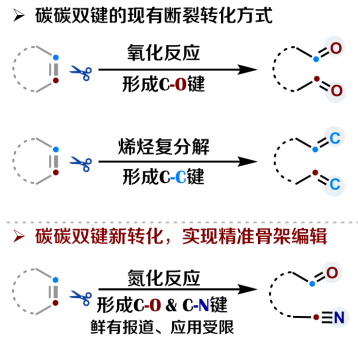
碳碳键构成了有机化合物的基本骨架,其断裂转化对化石能源利用、废弃聚烯烃及生物质转化、分子骨架编辑等领域至关重要。例如,石化工业中利用高温、高压或催化条件实现的石油裂化与裂解其本质是碳碳键断裂过程。

石油裂解过程的碳碳键断裂
碳碳双键在大宗化学品、天然产物及药物分子中广泛存在。长期以来,碳碳双键的断裂转化方式有限,主要集中于传统的氧化反应和烯烃复分解(获2005年诺贝尔化学奖),分别将碳碳双键转化为碳氧键和新的碳碳键。但是,经过碳碳双键断裂将氮原子引入分子中的氮化反应很少被实现。由于含氮化合物被广泛应用在农药、香料、染料、材料等领域,向分子中引入氮这一重要的生命元素能够显著提升分子功能或成药性,精准、高效的氮化反应一直是合成化学最受关注的领域之一。然而,由于碳碳键键能高、活性低、选择性难以控制,尤其是复杂分子中存在多个反应位点、反应环境复杂,实现复杂分子的双键断裂氮化反应更具挑战。
焦宁团队长期致力于碳碳键断裂转化研究(Acc. Chem. Res. 2014, 47, 1137; Acc. Chem. Res. 2017, 50, 1640)和分子骨架编辑研究(Acc. Chem. Res. 2024, 57, 3161; Acc. Chem. Res. 2025, 10.1021/acs.accounts.4c00846),并将所发展的氮化、氧化、卤化新方法应用于药物修饰改造及新药发现,所发展的用于光动力治疗和针对血脂异常的两个1.1类创新药物已分别获得批件,进入临床Ⅰ期试验。该团队前期基于碳碳键断裂已经实现了硝基甲烷作为氮源的施密特(Schmidt)反应(Science 2020, 367, 281)和苯环的开环转化(Nature 2021, 597, 64)。
围绕“碳碳双键氮化反应”这一关键科学问题,研究团队利用金属铜催化,通过控制叠氮自由基高效引发和诱导O-O键均裂,实现了烯烃高效、高选择性的双键断裂需氧氮化反应。研究团队进一步结合非均相催化,设计合成了新颖的CuO/h-TS-1催化剂,提高催化效率的同时实现了催化剂的循环利用。该方法不仅适用于简单烯烃底物,还能广泛应用于甾体、萜类和糖烯类等复杂分子的骨架重塑。例如,乳腺癌治疗药物醋酸甲地孕酮在此方法下可进一步转化为C7位碳-氮原子交换的骨架重塑产物。D-半乳烯糖衍生物可被转化为脱氧阿拉伯糖醇衍生物。该研究不仅为优势骨架分子编辑及合成提供了一种新颖、有效的合成工具,开拓分子新化学空间,还有望推动合成化学和药物发现等相关领域的发展。
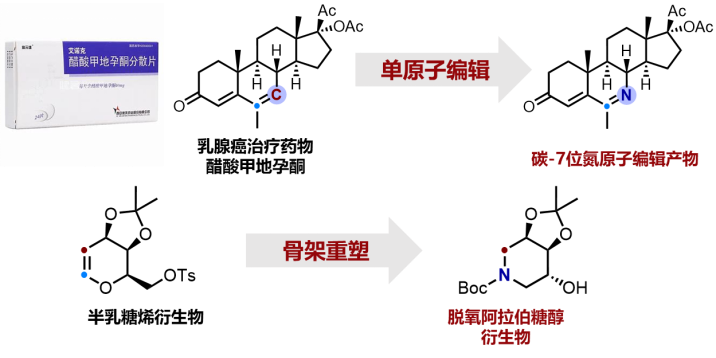
碳碳双键断裂氮化反应实现复杂分子重塑
“该方法像是一种‘分子手术刀’,可以选择性切断分子内的碳碳双键并实现分子骨架精准编辑。”焦宁教授解释,“这项工作历经四名博士生和博士后十余年的接续努力与不懈探索,解锁了我们在碳碳单键、双键、叁键及芳香环碳碳键断裂转化研究领域又一块重要拼图。”
北京大学药学院19级博士生程增瑞、18级博士生王琛、已出站博士后黄开盟、陈莉莉为论文共同第一作者。该研究与中石化石油化工科学研究院有限公司舒兴田研究团队合作,夏长久研究员为共同通讯作者。北京大学宋颂、上海大学郦鑫耀、北京化工大学王腾和曹鹏飞、中国科学院精密测量科学与技术创新研究院郑安民、浙江大学王亮等研究团队也对该工作给予了合作帮助。该工作得到国家重点研发计划项目、国家自然科学基金、昌平实验室和新基石研究员项目等资助。
原文链接:
https://www.science.org/doi/10.1126/science.adq8918
焦宁
焦宁教授长期致力于合成方法学、绿色化学、药物合成的绿色化、基于代谢类疾病的新药发现研究。在碳碳键活化、氧化反应、氮化反应、卤化反应等研究中取得了一系列创新性的成果,以通讯作者在Science、Nature、Nat. Chem. 、Nat. Catal. 、Nat. Metab.等杂志发表论文210余篇,获得临床批件2项。目前担任Chem. Sci.副主编及多个期刊编委,以第一完成人先后获得北京市自然科学一等奖、教育部自然科学一等奖、科学探索奖、新基石研究员等奖项。
(科研处、基础医学院、药学院)
编辑:韩娜


